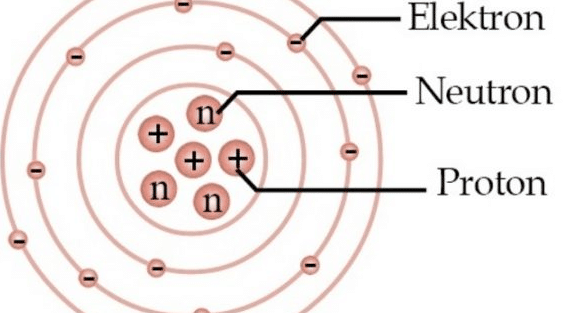
Partikel Penyusun Atom – Elektron, Proton, Neutron, Inti Atom – Atom adalah unit dasar dari materi yang terbentuk dari inti atom dan awan elektron bermuatan negatif yang mengitarinya.
Pengertian Atom
Pengertian atom pertama kali tercatat dalam sejarah oleh Leucippus dan Democritus dari Yunani pada awal tahun 500 SM – 400 SM. Mereka menyatakan bahwa segala materi dapat terbagi menjadi bagian-bagian yang lebih kecil hingga mencapai bagian terkecil yang tidak bisa dibagi lagi, yang disebut atomos (atom). Atom merupakan unsur terkecil penyusun segala materi yang ada. Artinya, atom atau atomos adalah partikel terkecil yang tidak dapat dibagi atau dipecah lagi.
Pandangan lain mengenai atom disampaikan oleh Aristoteles pada tahun 384 SM – 332 SM. Aristoteles berpendapat bahwa materi dapat terus-menerus dibagi menjadi bagian-bagian yang lebih kecil, yang bertentangan dengan pandangan Leucippus dan Democritus. Namun, pandangan Aristoteles ini tidak dianggap sebagai dasar ilmiah karena hanya berdasarkan pemikiran dan pengamatan, tanpa didukung oleh eksperimen.
Joseph John Thompson, seorang ahli fisika, memberikan pengertian baru tentang atom. Menurutnya, atom adalah sebuah bola bermuatan positif yang di dalamnya tersebar elektron-elektron seperti kismis. Istilah “atom” pertama kali digunakan oleh kimiawan Inggris bernama John Dalton (1766-1844) ketika ia mengemukakan teori atomnya pada tahun 1807.
Dalton menyatakan bahwa semua unsur kimia terdiri dari partikel-partikel yang sangat kecil yang disebut atom, yang tidak dapat dipecah saat zat-zat kimianya bereaksi. Selain itu, menurutnya, semua reaksi kimia terjadi karena atom-atom bergabung atau terpisah satu sama lain. Teori atom Dalton menjadi fondasi bagi ilmu pengetahuan modern.
Sejarah Penemuan Atom
Sejarah percobaan eksperimental tentang penemuan atom dimulai pada tahun 1803 oleh John Dalton, seorang ahli kimia Inggris yang merumuskan teori tentang atom atau Teori Atom. Pada tahun 1832, Michael Faraday melakukan penelitian yang mendukung penemuan atom dengan menemukan proses elektrolisis, yaitu memecah molekul menggunakan listrik.
Dmitri Mendeleev menyumbangkan kontribusi penting pada tahun 1869 dengan menyusun Hukum Periodik, yang mengorganisir unsur-unsur kimia ke dalam tabel yang berdasarkan sifat-sifat periodik mereka. James Clerk Maxwell juga berperan dalam perkembangan pemahaman tentang atom dengan melakukan percobaan tentang listrik dan medan listrik, yang menyumbang pemahaman tentang keberadaan elektron, pada tahun 1873.
Sir William Crookes melanjutkan penelitian pada tahun 1870, di mana ia secara eksperimental menemukan bahwa elektron memiliki massa melalui eksperimen sinar katoda yang ia lakukan. Selanjutnya, pada tahun 1886, E. Goldstein menemukan keberadaan proton, partikel bermuatan positif yang merupakan salah satu penyusun atom.
G.J. Stoney memberikan kontribusi penting pada tahun 1894 dengan menamai partikel negatif penyusun atom sebagai “elektron”, yang merupakan partikel yang menyebabkan konduktivitas listrik. Semua penemuan ini secara bertahap membentuk pemahaman kita tentang struktur dan komposisi atom.
Kemudian, pada tahun 1897, J.J. Thomson menemukan massa dari elektron menggunakan tabung sinar katoda. Pada tahun yang sama, dia juga menemukan keberadaan proton.
Selanjutnya, penelitian dilanjutkan oleh muridnya, yaitu Rutherford. Rutherford menemukan radiasi yang dipancarkan oleh uranium dan thorium, yang dikenal sebagai alpha dan beta. Dari hasil penelitiannya, Rutherford menyimpulkan bahwa ada sebuah inti dalam atom. Dia juga membuat hipotesis bahwa selain proton, ada partikel lain yang berperan dalam menjaga keseimbangan atom.
Hipotesis Rutherford kemudian dibuktikan oleh James Chadwick pada tahun 1932 dengan menemukan partikel atom yang disebut neutron, yang memiliki muatan netral. Meskipun sulit ditemukan karena muatannya yang netral, penemuan neutron ini melengkapi pemahaman kita tentang komponen atom.
Dengan penemuan seluruh partikel atom ini, maka model atom yang sebenarnya telah lengkap.
Partikel Penyusun Atom
X = Unsur
Z = Nomor atom (pada atom netral, elektron (e)= proton (p)
A = Bilangan massa= jumlah proton + neutron
Partikel dasar pembentuk atom terdiri atas proton, neutron dan elektron. Berikut pengertiannya:
- Neutron
Neutron tidak memiliki muatan atau bersifat netral, dan penemuan ini dilakukan oleh ahli fisika Inggris James Chadwick pada tahun 1932. - Proton
Proton memiliki muatan positif dan ditemukan oleh Goldstein pada tahun 1886. - Elektron
Elektron memiliki muatan negatif dan ditemukan oleh J.J. Thomson pada tahun 1897.
Elektron
Dalam konteks ini, saya memahami tentang tabung sinar katoda. Tabung televisi merupakan salah satu jenis tabung sinar katoda, di mana percobaan pertama dilakukan dengan tabung tersebut.
Hasil dari eksperimen ini adalah penemuan seberkas sinar yang bergerak dari katoda menuju anoda, yang kemudian dinamai sebagai sinar katoda oleh George Johnstone Stoney pada tahun 1891. Namun, Stoney tidak dapat menjelaskan konsep atom yang menyatakan bahwa unsur yang berbeda memiliki sifat yang berbeda, padahal keduanya memiliki elektron yang sama.
Pada tahun 1896, Antoine Henri Becquerel menemukan sinar yang dipancarkan dari unsur radioaktif, yang sifatnya mirip dengan elektron. Joseph John Thomson melanjutkan eksperimen William Crookes pada tahun 1897 dengan menguji pengaruh medan listrik dan medan magnet dalam tabung sinar katoda. Hasilnya menunjukkan adanya partikel bermuatan negatif dalam atom, karena sinar tersebut tertarik ke kutub positif medan listrik.
Besarnya muatan dalam elektron kemudian ditemukan oleh Robert Andrew Milikan pada tahun 1908. Dalam eksperimennya, tetesan minyak disemprotkan ke dalam tabung yang bermuatan listrik, dan gaya tarik gravitasi menyebabkan tetesan minyak turun. Bila tetesan minyak diberi muatan negatif, maka akan tertarik ke kutub positif medan listrik. Dari hasil percobaan Milikan dan Thomson, diperoleh muatan elektron sebesar -1 dan massa elektron sebesar 0, yang kemudian elektron dapat dilambangkan sebagai “0e-1”.
Proton
Jika massa elektron bernilai 0, itu akan menunjukkan bahwa partikel tersebut tidak memiliki massa, yang bertentangan dengan fakta bahwa partikel materi memiliki massa yang dapat diukur. Selain itu, mengenai sifat netral atom, pertanyaan muncul tentang bagaimana atom bisa tetap netral jika hanya terdiri dari elektron.
Eugene Goldstein pada tahun 1886 melakukan eksperimen menggunakan tabung gas yang dilengkapi dengan katoda yang memiliki lubang-lubang dan diberi muatan listrik. Melalui eksperimennya, Goldstein menemukan adanya partikel lain dalam atom selain elektron. Partikel ini kemudian dinamakan proton. Dengan adanya proton yang bermuatan positif dan elektron yang bermuatan negatif, jumlah muatan positif dan negatif dalam atom menjadi seimbang, menjadikan atom bersifat netral secara keseluruhan. Ini menjelaskan bagaimana atom bisa tetap netral meskipun terdapat elektron di dalamnya.
Inti Atom
Setelah penemuan proton dan elektron, Ernest Rutherford melakukan penelitian dengan menembakkan sinar pada lempeng tipis. Logika yang mendasari percobaan tersebut adalah jika atom terdiri dari partikel yang bermuatan positif dan negatif, seharusnya sinar alpha yang ditembakkan tidak akan diteruskan atau menembus lempeng tersebut. Dari sinilah muncul konsep inti atom.
Pada tahun 1911, Ernest Rutherford, dibantu oleh Hans Geiger dan Ernest Marsden, menemukan konsep inti atom. Penemuan ini didukung oleh penemuan sinar-X oleh W.C. Rontgen pada tahun 1895 dan penemuan zat radioaktif pada tahun 1896.
Neutron
Prediksi dari Rutherford mendorong W. Bothe dan H. Becker pada tahun 1930 untuk melakukan eksperimen penembakan partikel alpha pada inti atom berilium (Be). Hasilnya, terdeteksi radiasi partikel dengan daya tembus tinggi.
Eksperimen ini kemudian dilanjutkan oleh James Chadwick pada tahun 1932. Ternyata, partikel yang menyebabkan radiasi berdaya tembus tinggi tersebut bersifat netral atau tidak bermuatan, dan massanya hampir sama dengan proton. Partikel ini kemudian dinamakan neutron dan dilambangkan dengan “n”.