Pengertian Atom, Struktur, Macam, Kelebihan dan Kekurangan – Atom memiliki asal kata dari bahasa Yunani “ἄτομος/átomos, α-τεμνω” yang artinya tidak bisa dipotong atau dibagi-bagi lagi. Atom ialah partikel yang tak dapat dibagi lagi dikemukakan pertama kali oleh filsuf Yunani dan India.
Abad ke-17 dan 18, para kimiawan menjadikan dasar-dasar pemikiran ini dengan memperlihatkan bahwa zat-zat tertentu tidak dapat lagi dibagi menjadi lebih kecil dengan metode-metode kimia.
Pengertian Atom, Struktur, Macam, Kelebihan dan Kekurangan
Pada akhir abad 19 dan 20, para fisikawan mampu membuktikan bahwa atom benar-benar tak dapat dibagi lagi.
Pengertian Atom
Atom merupakan sebuah satuan dasar materi yang tersusun dari inti atom dan awan elektron dengan muatan negatif di sekitarnya. Inti atom tersusun dari proton bermuatan positif serta neutron bermuatan netral. Ukuran diameter atom kurang lebih 6 mm – 30 mm. Gaya elektromagnetik menyebabkan atom berkumpul dan membentuk suatu molekul.

Pengertian Atom Menurut Para Ahli
Beberapa ahli memberikan definisinya tentang atom.
Lecipus dan Democritus
Menurut Lecipus dan Democritus, atom ialah bagian paling kecil dari sebuah materi yang tak bisa dibagi lagi menjadi bagian-bagian tertentu. Atom merupakan penyusun dari semua materi di dunia.
John Dalton
John Dalton berpendapat bahwa atom merupakan partikel paling kecil dari sebuah zat yang tidak bisa diuraikan lagi menjadi partikel yang lebih kecil melalui rekasi kimia biasa.
Joseph John Thompson
Joseph John Thompson mengemukakan bahwa atom merupakan sebuah bola dengan muatan positif dan dikelilingi elektron layaknya roti kismis.
Ernest Rutherford
Ernest Rutherford memandang atom sebagai suatu partikel yang asalnya dari neutron dan proton yang dikelilingi elektron.
Struktur Atom
Inti atom merupakan bagian yang sangat padat di mana 99,97% dari massa atom. Namun, volume inti atom hanya dari volume atom. Atom berdiameter sekitar 10-10 m, sekitar 100.000 kali diameter dalam inti atom (10-15 m ). Di bawah ini terdapat gabar yang menunjukkan struktur atom serta tabel perbandingan 3 partikel sub atomik.
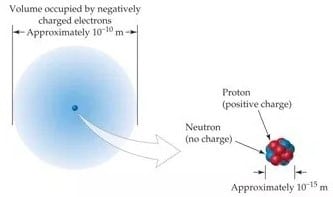
|
Partikel |
Simbol | Muatan | Massa | Lokasi dalam atom | ||
| Relatif | Absolut (C) | Relatif (sma) |
Absolut (g) |
|||
| Proton (p+) | – | +1 | +1,60218 x 10-19 | 1,00727 » 1 | 1,67262 x 10-24 |
Inti atom |
| Neutron (n0) | 0 | 0 | 1,00866 » 1 | 1,67493 x 10-24 |
Inti atom |
|
| Elektron (e-) | -1 | -1,60218 x 10-19 | 0,00054858 » 0 | 9,10939 x 10-28 |
Luar inti atom |
|
Nilai massa atom beserta partikel-partikel sub satomik sangat kecil dan dinyatakan dalam satuan gram sehingga akan lebih mudah untuk dikatakan sebagai massa yang relatif. Dasar ukuran massa realtif atom ialah atom karbon yang didasarkan pada 6 proton dan 6 neutron (atom C-12), di mana massa satu atom C-12 sama dengan 12 satuan massa atom (sma) atau 12 Dalton (Da). 1 sma sama dengan 1,660539 x 10-24 g. Inti dari massa neutron dan proton masing-masing sebesar 1 sma.
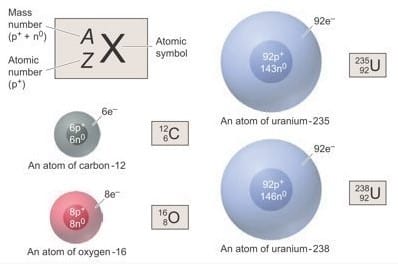
Macam-Macam Teori Atom dengan Kelebihan dan Kekurangannya
Terdapat lima teori model atom yang dikemukakan para ahli. Berikut penjelasan teori model atom para ahli dengan masing-masing kelebihan dan kekurangannya.
Model Atom John Dalton
Teori model atom oleh John Dalton memiliki kesipulan bahwa :
- Atom ialah bagian paling kecil dari sebuah materi yang tidak meungkin lagi untuk bagi menjadi bentuk yang lebih kecil.
- Atom digambarkan sebagai bola pejal yang amat kecil di mana masing-masing unsur mempunyai atom-atom berbeda dan ciri khas.
- Atom bisa bergabung dengan atom lain lalu membentuk suatu senyawa dengan perbandingan bilangan yang sederhana dan bulat.
- Atom tidak bisa dimusnahkan atau diciptakan sebab rekasi kimia yang menjadi pemisah atau penggabung atau penyusun kembali atom-atom tersebut.
Kelebihan teori ini yaitu menumbuhkan minat pada eksperimen mengenai model atom meningkat tinggi. Kekuranannya ialah tidak memaparkan cara sebuah larutan yang bisa menghantarkan listrik sebab bola pejal tidak dapat mengahantarkan listrik sedangkan listrik ialah elektron yang selalu bergerak. Ini menunjukkan terdapat partikel lain yang mampu menghantarkan listrik.
Model Atom J. J. Thomson
Menurut Thomson, atom ialah sebuah bulatan (bola pejal) dengan muatan positif dengan muatan yang rapi serta merata. Dalam muatan positif tersebut elektron-elekton negatif dan positif dengan besar yang sama tersebar.
Kelebihan model teori atom ini yaitu atom bukan bagian paling kecil suatu unsur sebab mempunyai partikel-partikel dengan muatan negatif di dalamnya. Kelemahan teori ini yaitu tidak menjelaskan susunan muatan positif maupun negatif di dalam bola atom.
Model Atom Rutherford
Rutherford menyatakan terdapat gejala-gejala yang menimbulkan kesimpulan :
- Atom bukan bola pejal sebab hampr seluruh partikel alfa diteruskan.
- Apabila lempeng emas dianggap sebagai sebuah lapisan atom emas, maka ada partikel-partikel kecil bermuatan positif dalam atom tersebut.
- Partikel itu ialah partikel penyusun inti atom. Faktanya 1 dari 20.000 partikel alfa dibelokkan. Dengan perbandingan tersebut sebagai diameter, maka ukuran inti atom diperkirakan 10.000 kali lebih kecil dari total ukuran atom.
Kelebihan teori ini yaitu adanya hipotesa bahwa atom disusun dari inti atom dan elektron yang mengitari inti yang kemudian menginspirasi penemuan baru mengenai kedudukan atau lintasan elektron yang disebut kulit elektron. Kelemahan teori ini yaitu tidak menjabarkan alasan elektron tidak jatuh ke inti atom.
Model Atom Niels Bohr
Niels Bohr memadukan teori Rutherford dan Planck dan menyimpulkannya :
- Elektron dalam atom bergerak mengitari lintasan tertentu (kulit atau tingkat neergi elektron) dan tidak memancarkan energi.
- Elektron dapat berpindah-pindah lintasan.
- Perpindahan lintasan elektron dari energi tinggi menuju energi rendahdiikuti penyerapan energi.
- Elektron bergerak di lintasannya dalam kondisi stasioner (tidak menyerap atau memancarkan energi).
Kelebihan teori ini yaitu atom mempunyai kulit-kulit sebagai tempat perpindahan elektron. Kelemahan teori ini yaitu tidak menerangkan efek Zeeman dan efek Strack.
Model Atom Modern
Erwin Schrodinger (1926) menerangkan tentang model atom ini setelah Werner Heisenberg mengembangkan teori mekanika kuantum yang populer dengan prinsip ketidakpastian yakni “tidak mungin bisa ditentukan yaitu kebolehjadian menemukan elektron di waktu yang bersamaan, yang bisa ditentukan yakni kebolehjadian menemukan elektron dengan jarak tertentu dari inti atom”.
Kelebihan teori ini yaitu bisa meunjukkan adanya lintasan elektron bagi atom hidrogen. Kelemahannya yaitu hanya menjelaskan atom-atom dengan elektron tunggal tanpa mampu menjelaskan spektrum warna atom dengan banyak elektron.
Sekian penjelasan materi Pengertian Atom, Struktur, Macam, Kelebihan dan Kekurangan. Terima kasih sudah mengunjungi website kami dan baca juga artikel kami lainnya 🙂
